 |
| Figura 1.- Desarrollo del embrión a lo largo de su viaje por la trompa de Falopio. Modificado de Ttrue12 en Wikimedia Commons |
Tras la fertilización, el zigoto-embrión (denominado 'conceptus') permanece aún en la trompa de Falopio durante aproximadamente 72 horas. En ese tiempo, el zigoto de 1 célula con 46 cromosomas, consecuencia de la fusión de los pronúcleos masculino y femenino, duplica su ADN y se divide en 2 células (pinchar aquí para ver el proceso que tiene lugar hasta la formación del zigoto). Éstas a su vez en 4 y así sucesivamente hasta el estado de mórula (12 células o más) que crece y se convierte en blastocisto. Al mismo tiempo que se desarrolla el embrión, éste viaja por la trompa de Falopio en busca del útero. Por su parte, el endometrio se prepara para la implantación del embrión.
El estadio de mórula es una masa compacta en la que apenas se pueden distinguir las células individuales. Por su parte, el blastocisto es una estructura celular con una cavidad central llena de fluido en el que ya se puede apreciar una diferente estructuración de las células. Las que forman la capa exterior del blastocisto constituyen el trofoblasto, que se desarrollarán en estructuras de soporte. Las células del interior, o masa celular interna, son las que formarán el embrión propiamente dicho. Una vez el blastocisto alcanza el útero, permanece flotando en él durante otras 72 horas hasta que se implanta. Por lo tanto, la implantación del blastocisto humano sucede entre el día 6 y 7 tras la ovulación.
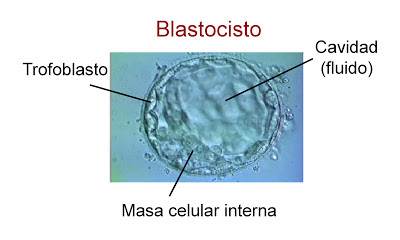 |
| Figura 3.- Diferentes partes del blastocisto. Foto tomada de www.reproduccionasistida.org |
En el siguiente enlace se puede ver en un vídeo el desarrollo de varios zigotos humanos a lo largo de 6 días (enlace; debéis bajar hasta aproximadamente la mitad de la página, buscar 'Movie - 1' y pinchar en 'Supplementary video 1'). En este vídeo se puede apreciar que los zigotos se desarrollan a diferentes velocidades. Hacia la mitad del vídeo los embriones cambian de lugar debido a un cambio del medio de cultivo; sin embargo siguen reconocibles por las letras que los etiquetan. Los embriones A, B, C, D, F, H, K, L, M y N se convierten en blastocistos, mientras que el resto no continúa más allá de los primeros estadios. En los blastocitos se puede ver la capa externa de células (trofoblasto), la cavidad interna en donde se localiza el líquido y las células de la masa interna.
En ese mismo vídeo se puede ver en el embrión H que, alrededor del minuto 1:17, una masa sobresale en la parte superior, por donde van pasando todas las células del blastocisto. Este proceso se denomina eclosión del blastocisto y es fundamental para su implantación. Lo que sucede es que el embrión sale de la "cápsula" de zona pelúcida que lo protege a modo de cáscara del huevo. Se piensa que el fallo en la eclosión del blastocisto puede ser uno de los factores que intervienen en el Fallo Recurrente de Implantación que se da en algunas mujeres sometidas a Fertilización In Vitro.
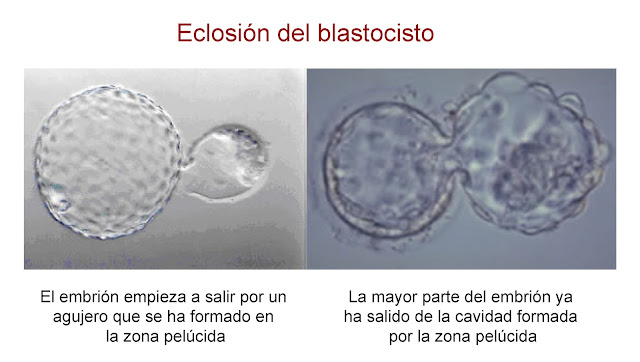 |
| Figura 4.- Eclosión del blastocisto (blastocyst hatching). Foto tomada de www.reproduccionasistida.org |
 |
| Figura 5.- Esquema de un óvulo y su entorno, donde se puede apreciar la zona pelúcida que lo rodea (verde). |
Tras la fertilización, la zona pelúcida sufre un proceso de endurecimiento que tiene varias funciones: evitar la entrada de más espermatozoides, además de proteger la integridad del embrión antes de la implantación y facilitar el transporte del mismo a través de las trompas de Falopio. Además, protege al embrión de microorganismos y del sistema inmune. Durante los primeros estadios del blastocisto, la zona pelúcida es necesaria para mantener la integridad de la masa celular interna. Sin embargo, posteriormente se desprende, lo que permite la implantación del blastocisto.
Hay dos mecanismos que ayudan a este proceso de eclosión. Por una parte, el mecanismo químico por el cual unas proteasas (enzimas que rompen proteínas) producidas por el embrión y/o el útero, digieren la zona pelúcida. Por otro lado, los ciclos de expansión y contracción del blastocisto, que se pueden apreciar en el vídeo anterior, hacen más delgada la zona pelúcida, lo que facilita el desprendimiento de ésta. Como consecuencia de estos procesos, se genera un pequeño orificio en la zona pelúcida por donde pasa el embrión (vídeo). Una vez eclosionado, las células del trofoblasto interaccionan con las células del endometrio que cubren el útero y se produce la implantación del embrión.
Al mismo tiempo que se desarrolla el embrión, el endometrio del útero sufre una serie de modificaciones que le hacen receptivo para su implantación.
El útero está formado por dos capas: endometrio y miometrio. Esta última es la capa muscular encargada de genera las contracciones que expulsan al bebé cuando llega su momento. Sobre él se sitúa el endometrio, formado a su vez por varias capas. La más externa es una capa de células epiteliales en forma de columnas. A continuación y hasta el miometrio, se encuentra la capa más gruesa de células estromales. Embebidas en el endometrio también se encuentran las glándulas endometriales secretoras, formadas por células epiteliales.
 |
| Figura 6.- Diferentes capas del útero: miometrio y endometrio. Endometrio: epitelio, glándulas endometriales secretoras, estroma. Las imágenes proceden de http://www.proteinatlas.org. |
El endometrio de una mujer en época fértil se considera que tiene dos estratos: uno basal (basalis) más profundo y otro más superficial que constituye la capa funcional, en la que pueden distinguir a su vez, la zona compacta (superficial) y la zona esponjosa (próxima a la capa basal). Durante la fase menstrual del ciclo (del día 1 al día 4-6) se pierde la capa funcional. A continuación, en la fase proliferativa (hasta la ovulación), las glándulas endometriales, el estroma y el endotelio vascular de la capa funcional proliferan a partir de la basal. Como consecuencia el endometrio aumenta su volumen. Durante la fase secretora (desde la ovulación hasta el final del ciclo) las glándulas endometriales presentan una gran actividad y el endometrio sufre cambios con el objetivo de albergar el embrión. El aumento de la vascularización del endometrio es uno de ellos. Además, las células estromales comienzan un proceso de predecidualización en el que se diferencian a células deciduales formando la zona compacta, lo que se produce entre los días 9 y 10 tras la ovulación (días 23 y 24 del ciclo).
 |
| Figura 7.- Dos secciones histológicas de útero humano en dos momentos diferentes del ciclo menstrual. La imagen de la izquierda muestra el endometrio compacto de la fase proliferativa (pre-ovulatoria). A la derecha se muestra el endometrio más grueso y con mayor desarrollo de las glándulas secretoras, propio de la fase secretora (post-ovulatoria). Las imágenes proceden de la Universidad de Columbia. |
Este desarrollo del endometrio lo hace receptivo a la implantación del embrión, ventana de receptividad que se da entre los días 7 y 10 tras la ovulación (días 20 a 24 del ciclo). Uno de los primeros procesos que tienen lugar es que se completa la decidualización, lo que da lugar a la decidua, el endometrio especializado del embarazo. Se tienen evidencias de que la presencia del embrión en el endometrio promueve este proceso. De hecho, el blastocisto se prepara a su vez para la implantación a través de diferentes mecanismos. Por una parte, expresa en su superficie una serie de moléculas que le servirán para adherirse al endometrio uterino (moléculas de adhesión). Además, secreta moléculas con diferentes funciones: evitar el rechazo por parte del sistema inmune de la madre, guiar al embrión para elegir su lugar de implantación (quimoquinas) e invadir el endometrio materno (citoquinas).
 |
| Figura 8.- Imagen de un embrión humano de 6 días de edad (naranja) durante el proceso de implantación en el endometrio materno (púrpura). Autor: Yorgor Nikas, Wellcome Images. |
La implantación del embrión es el proceso crítico en el desarrollo del embarazo. Se considera que en el 75% de los embarazos fallidos, la causa es un defecto en la implantación. Este proceso pasa por 3 fases: aposición, adhesión e invasión.
- Aposición.- Son los primeros contactos del blastocisto con la capa más superficial del útero. Las células del trofoblasto interaccionan de forma muy ligera con las células del epitelio del endometrio. Para ello la zona pelúcida debe haber sido eliminada o al menos digerida parcialmente para permitir esta interacción. En humanos, el embrión se orienta de modo que la masa celular interna se sitúa próxima al epitelio.
- Adhesión.- El trofoblasto se adhiere al epitelio uterino a través de las microvellosidades de sus células. Aquí están implicadas moléculas de adhesión en ambos tipos celulares que interaccionan entre sí. Integrinas, proteínas de la matriz extracelular y proteoglucanos son algunas de las moléculas implicadas en este proceso de adhesión.
- Invasión.- Conforme se adhiere el blastocisto al epitelio del endometrio, las células del trofoblasto proliferan muy rápido. Parte de esas células extienden protusiones que se introducen en el endometrio, entre las células del epitelio. Además, el trofoblasto secreta varios factores que favorecen la invasión del endometrio. La progresión de este proceso hace que finalmente el blastocisto quede embebido en el endometrio (decidua) y alcance los vasos sanguíneos de la madre.
 |
| Figura 9.- Proceso de implantación del embrión en el endometrio uterino. |
Vídeo
- http://www.nature.com/nbt/journal/v28/n10/full/nbt.1686.html
Referencias
- "Medical Physiology". WF Boron, EL Boulpaep. 2ª edición. 2012. Elsevier Saunders.
- "Non-invasive imaging of human embryos before embryonic genome activation predicts development to the blastocyst stage." CC Wong, KE Loewke, NL Bossert, B Behr, CJ De Jonge, TM Baer, RA Reijo Pera. Nat. Biotechnol. 2010, 28(10);1115-21.
- "Assisted hatching of human embryos: a systematic review and meta-analysis of randomized controlled trials". WP Martins, IA Rocha, RA Ferriani, CO Nastri. Human Reproduction Update, 2011, Vol.17, No.4 pp. 438–453
- "Recurrent implantation failure: gamete and embryo factors". M Das, HEG Holzer. Fertil Steril 2012;97:1021–7.
- "Assisted hatching in assisted reproduction: a state of the art. ME Hammadeh, C Fischer-Hammadeh, KR Ali. J Assist Reprod Genet 2011, 28:119–128
- "Tratado de reproducción humana para enfermería". JR Matorras Weinig, J Hernández Hernández, Dolores Molero Bayarri. (online)
- “Mechanisms of implantation: strategies for successful pregnancy”. J Cha, X Sun, SK Dey. Nature Medicine 2012, 18 (12): 1754-1767.
- The Human Protein Atlas (enlace)
- “Embryonic implantation: cytokines, adhesion molecules, and immune cells in establishing an implantation environment”. MSM van Mourik, NS Macklon, CJ Heijnen. J. Leukoc. Biol. 2009, 85: 4–19.
- “The maternal to zygotic transition in mammals”. L Li, X Lu, J Dean. Molecular Aspects of Medicine 2013.
Imágenes
- Figura 1.- Modificado de Ttrue12 en Wikimedia Commons
- Figura 2.- Tomado de “The maternal to zygotic transition in mammals”. L Li, X Lu, J Dean. Molecular Aspects of Medicine 2013.
- Figuras 3 y 4.- Imágenes tomadas de http://www.reproduccionasistida.org
- Figura 6.- Imágenes tomadas de The Human Protein Atlas (enlace)
- Figura 7.- Universidad de Columbia (enlace)
- Figura 8.- Autor: Yorgor Nikas, Wellcome Images.
